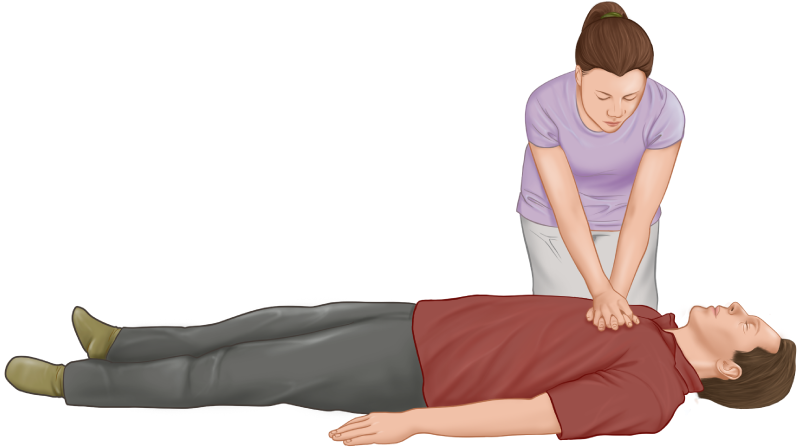
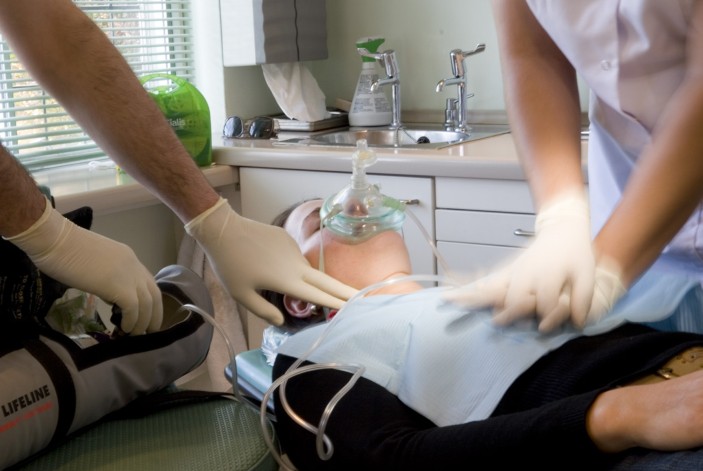
CPR steht für Herz-Lungen-Wiederbelebung. Es ist ein lebensrettendes Erste-Hilfe-Notfallverfahren, das durchgeführt wird, um das Gehirn des Opfers funktionsfähig zu halten, bis weitere medizinische Hilfe verfügbar ist. CPR wird bei Menschen durchgeführt, die nicht reagieren und keine Atmung haben. Bei korrekter Ausführung erhöht es die Überlebenschancen des Opfers erheblich. Wenn man das Training für CPR bekommt,… HLW: Unverzichtbare Erste Hilfe, um Leben zu retten weiterlesen
Kategorie: Reanimation
Was sind die sieben Schritte der HLW?
Herz-Lungen-Wiederbelebung (CPR) – Erste Hilfe CPR steht für CardioPulmonary Resuscitation, ein Notfallverfahren, das eine Kombination aus Herzdruckmassage und künstlicher Beatmung (Beatmung) ist, um das Leben einer Person zu retten, wenn das Herz einer Person aufhört zu schlagen oder zu atmen. Bei sofortiger Durchführung kann die CPR die Überlebenschancen einer Person nach einem Herzstillstand erhöhen. Was… Was sind die sieben Schritte der HLW? weiterlesen
Herz-Lungen-Wiederbelebung (CPR)
Was ist Herz-Lungen-Wiederbelebung (CPR)? Die Herz-Lungen-Wiederbelebung (CPR) wird im Notfall eingesetzt, wenn jemand nicht normal atmet oder sein Herz stehen geblieben ist (Herzstillstand). Diese Kombination von Techniken wird verwendet: Herzkompressionen Rettungsatmung (Mund-zu-Mund). CPR hilft, den Blutkreislauf aufrechtzuerhalten und versorgt den Körper mit Sauerstoff, bis eine Behandlung durch einen Spezialisten verfügbar ist. Es ist normalerweise noch… Herz-Lungen-Wiederbelebung (CPR) weiterlesen
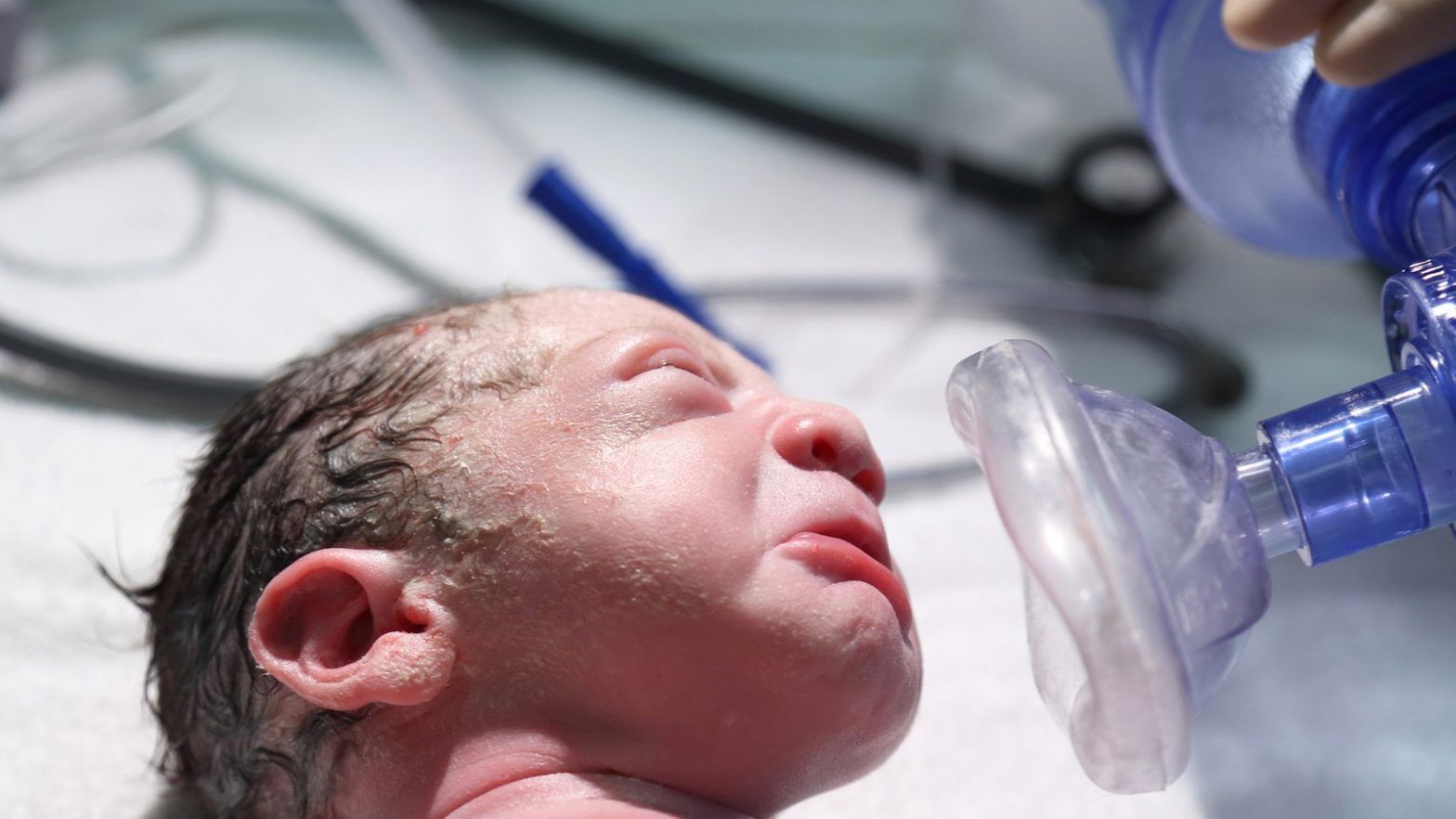
Wiederbelebung von Neugeborenen
Umfangreiche physiologische Veränderungen begleiten den Geburtsvorgang und demaskieren manchmal Zustände, die während des intrauterinen Lebens kein Problem darstellten. Aus diesem Grund muss bei jeder Geburt eine Person mit Kenntnissen in der Neugeborenen-Wiederbelebung anwesend sein. Gestationsalter und Wachstumsparameter helfen, das Risiko einer neonatalen Pathologie zu erkennen. Etwa 10 % der Neugeborenen benötigen bei der Geburt Atemunterstützung.… Wiederbelebung von Neugeborenen weiterlesen
2010 Richtlinien der American Heart Association für die Herz-Lungen-Wiederbelebung
Die folgenden Richtlinien sind eine Interpretation der im Internationalen Konsens von 2010 zur kardiopulmonalen Reanimation und kardiovaskulären Notfallmedizin mit Behandlungsempfehlungen vorgelegten Erkenntnisse1). Sie gelten in erster Linie für Neugeborene, die sich vom intrauterinen zum extrauterinen Leben befinden, aber die Empfehlungen gelten auch für Neugeborene, die den perinatalen Übergang abgeschlossen haben und in den ersten Wochen… 2010 Richtlinien der American Heart Association für die Herz-Lungen-Wiederbelebung weiterlesen
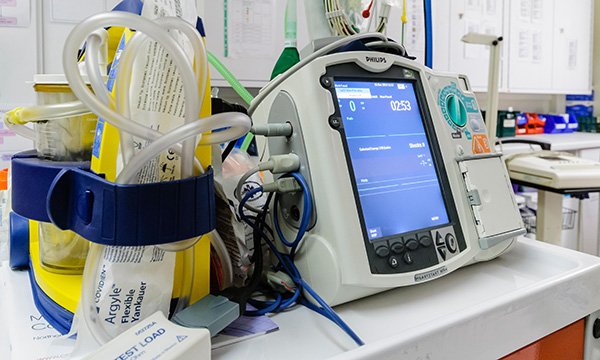
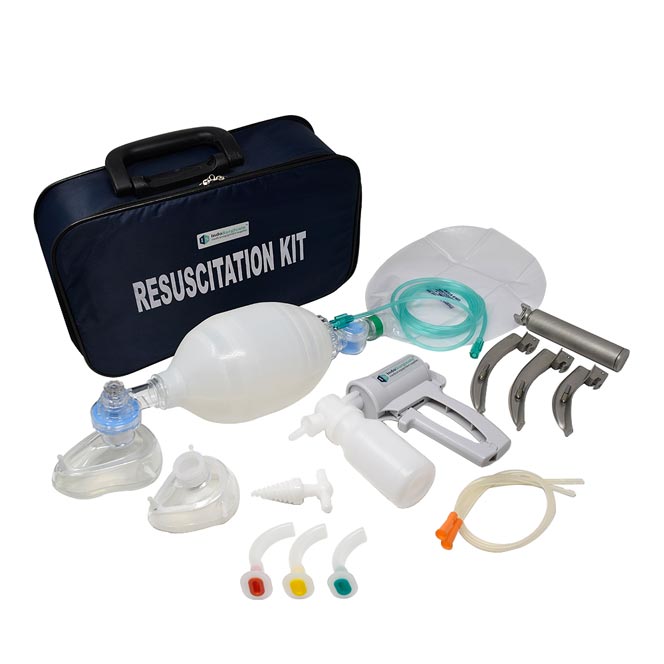
Geräte zur Herz-Lungen-Wiederbelebung
Wiederbelebungsausrüstung „Reanimationsgeräte werden relativ selten verwendet, und es spricht vieles dafür, Artikel auszuwählen, die sowohl einfach zu verwenden als auch zu warten sind Niveau, das der erwarteten Rolle des Einzelnen entspricht. Jede Praxis sollte eine benannte Person haben, die dafür verantwortlich ist, den Bereitschaftszustand aller Reanimationsmedikamente und -geräte, einschließlich des AED, regelmäßig zu überprüfen, idealerweise… Geräte zur Herz-Lungen-Wiederbelebung weiterlesen
Reanimationsgeräte auf Intensivstationen
1. REBELEBUNGSAUSRÜSTUNG AUF DER ICU 2. Einführung •Zu den Geräten der Intensivstation (ICU) gehören Patientenüberwachung, Atmungs- und Herzunterstützung, Schmerzbehandlung, Notfall-Wiederbelebung und andere lebenserhaltende Geräte . 3. Weiter… • Sie sind für die Versorgung von Patienten konzipiert, die schwer verletzt sind, an einer kritischen oder lebensbedrohlichen Krankheit leiden oder sich einem größeren chirurgischen Eingriff unterzogen haben,… Reanimationsgeräte auf Intensivstationen weiterlesen
Wiederbelebungsstrategien bei traumatischem hämorrhagischem Schock
Abstrakt Die Behandlung von Traumapatienten mit hämorrhagischem Schock ist komplex und schwierig. Trotz unseres in den letzten Jahrzehnten angesammelten Wissens über die Pathophysiologie des hämorrhagischen Schocks bei Traumapatienten bleibt die Sterblichkeitsrate dieser Patienten hoch. In der Akutphase der Blutung steht die möglichst rasche Blutstillung im Vordergrund. Solange diese Blutung unkontrolliert ist, muss der Arzt die… Wiederbelebungsstrategien bei traumatischem hämorrhagischem Schock weiterlesen
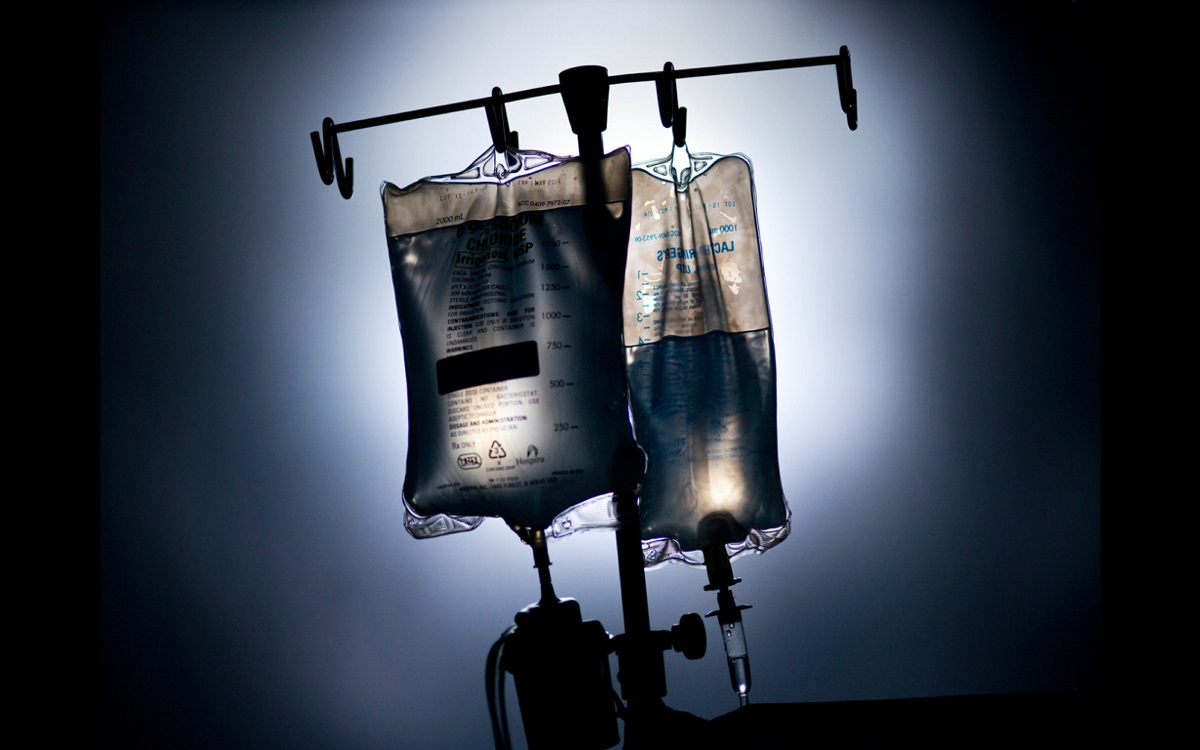
Flüssigkeitsreanimationsmanagement bei Patienten mit Verbrennungen: Update
Abstrakt Seit 1968, als Baxter und Shires die Parkland-Formel entwickelten, wurden auf dem Gebiet der Flüssigkeitstherapie zur Wiederbelebung von Verbrennungen trotz Fortschritten bei der hämodynamischen Überwachung, der Einführung des Konzepts der „zielgerichteten Therapie“ und der Entwicklung neuer Kolloid kaum Fortschritte erzielt und kristalloide Lösungen. Verbrennungspatienten erhalten in den ersten Stunden eine größere Flüssigkeitsmenge als alle… Flüssigkeitsreanimationsmanagement bei Patienten mit Verbrennungen: Update weiterlesen
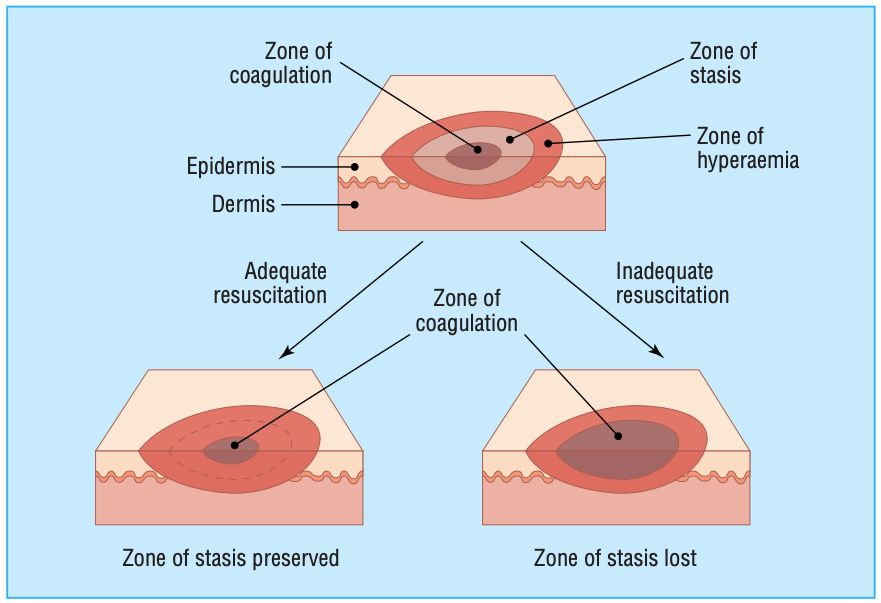
Erste Wiederbelebung von Patienten mit kritischen Verbrennungen: Fortschritte und Probleme
Ziel der Reanimation von Verbrennungspatienten ist es derzeit, die Endorgandurchblutung bei möglichst geringer Flüssigkeitsaufnahme aufrechtzuerhalten. Um eine übermäßige Zufuhr zu vermeiden, können wir die Schätzung mithilfe von Computermethoden verbessern. Parkland und Brooke sind die am häufigsten verwendeten Formeln, und kürzlich wird eine neue, einfache Formel verwendet, nämlich die „Zehnerregel“. Die Flüssigkeitsreanimation sollte titriert werden, um… Erste Wiederbelebung von Patienten mit kritischen Verbrennungen: Fortschritte und Probleme weiterlesen