Wiederbelebungsausrüstung „Reanimationsgeräte werden relativ selten verwendet, und es spricht vieles dafür, Artikel auszuwählen, die sowohl einfach zu verwenden als auch zu warten sind Niveau, das der erwarteten Rolle des Einzelnen entspricht. Jede Praxis sollte eine benannte Person haben, die dafür verantwortlich ist, den Bereitschaftszustand aller Reanimationsmedikamente und -geräte, einschließlich des AED, regelmäßig zu überprüfen, idealerweise… Geräte zur Herz-Lungen-Wiederbelebung weiterlesen
Kategorie: CPR-Ausrüstung
Reanimationsgeräte auf Intensivstationen
1. REBELEBUNGSAUSRÜSTUNG AUF DER ICU 2. Einführung •Zu den Geräten der Intensivstation (ICU) gehören Patientenüberwachung, Atmungs- und Herzunterstützung, Schmerzbehandlung, Notfall-Wiederbelebung und andere lebenserhaltende Geräte . 3. Weiter… • Sie sind für die Versorgung von Patienten konzipiert, die schwer verletzt sind, an einer kritischen oder lebensbedrohlichen Krankheit leiden oder sich einem größeren chirurgischen Eingriff unterzogen haben,… Reanimationsgeräte auf Intensivstationen weiterlesen
Wiederbelebungsstrategien bei traumatischem hämorrhagischem Schock
Abstrakt Die Behandlung von Traumapatienten mit hämorrhagischem Schock ist komplex und schwierig. Trotz unseres in den letzten Jahrzehnten angesammelten Wissens über die Pathophysiologie des hämorrhagischen Schocks bei Traumapatienten bleibt die Sterblichkeitsrate dieser Patienten hoch. In der Akutphase der Blutung steht die möglichst rasche Blutstillung im Vordergrund. Solange diese Blutung unkontrolliert ist, muss der Arzt die… Wiederbelebungsstrategien bei traumatischem hämorrhagischem Schock weiterlesen
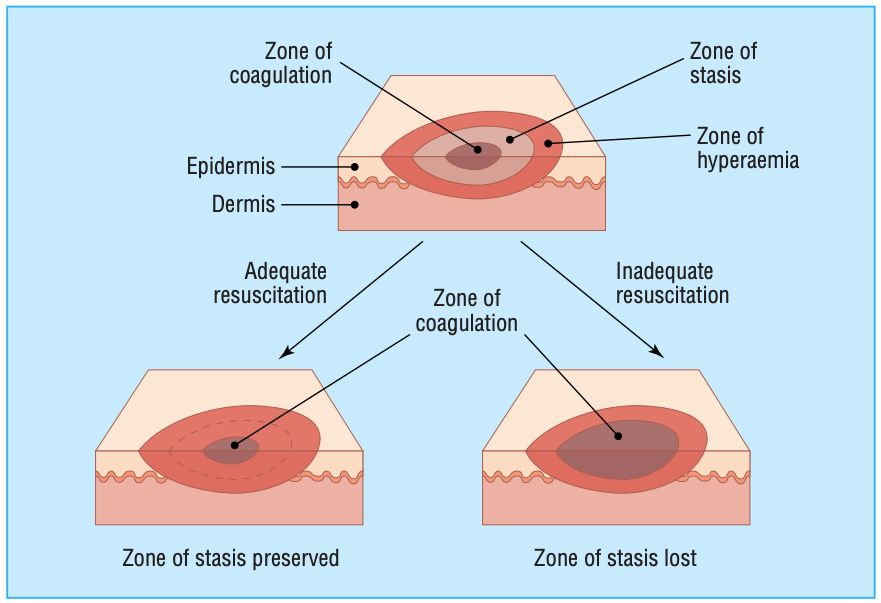
Flüssigkeitsreanimationsmanagement bei Patienten mit Verbrennungen: Update
Abstrakt Seit 1968, als Baxter und Shires die Parkland-Formel entwickelten, wurden auf dem Gebiet der Flüssigkeitstherapie zur Wiederbelebung von Verbrennungen trotz Fortschritten bei der hämodynamischen Überwachung, der Einführung des Konzepts der „zielgerichteten Therapie“ und der Entwicklung neuer Kolloid kaum Fortschritte erzielt und kristalloide Lösungen. Verbrennungspatienten erhalten in den ersten Stunden eine größere Flüssigkeitsmenge als alle… Flüssigkeitsreanimationsmanagement bei Patienten mit Verbrennungen: Update weiterlesen
Erste Wiederbelebung von Patienten mit kritischen Verbrennungen: Fortschritte und Probleme
Ziel der Reanimation von Verbrennungspatienten ist es derzeit, die Endorgandurchblutung bei möglichst geringer Flüssigkeitsaufnahme aufrechtzuerhalten. Um eine übermäßige Zufuhr zu vermeiden, können wir die Schätzung mithilfe von Computermethoden verbessern. Parkland und Brooke sind die am häufigsten verwendeten Formeln, und kürzlich wird eine neue, einfache Formel verwendet, nämlich die „Zehnerregel“. Die Flüssigkeitsreanimation sollte titriert werden, um… Erste Wiederbelebung von Patienten mit kritischen Verbrennungen: Fortschritte und Probleme weiterlesen
Damage Control Reanimation bei Polytraumapatienten
Abstrakt Ein Polytrauma tritt auf, wenn eine Person häufig, aber nicht immer, infolge von Explosionsereignissen Verletzungen an mehreren Körperteilen und Organsystemen erleidet. TBI tritt häufig bei Polytrauma in Kombination mit anderen behindernden Zuständen auf, wie Amputation, Verbrennungen, Rückenmarksverletzung, Hör- und Sehschäden, Rückenmarksverletzung (SCI), posttraumatische Belastungsstörung (PTBS) und andere Erkrankungen. Aufgrund der Schwere und Komplexität ihrer… Damage Control Reanimation bei Polytraumapatienten weiterlesen
Erfolgreiche Wiederbelebung bei versehentlicher Unterkühlung
Das 27 Monate alte Kleinkind (Körpergewicht 14 kg), das in einem kleinen Dorf ∼60 km von Krakau lebt, verließ spontan das Haus – wahrscheinlich zwischen 3 und 4 Uhr morgens, als die Außentemperatur über Nacht –7 °C betrug. Seine Abreise wurde vor 7 Uhr morgens entdeckt. Der Junge wurde von einem Polizeibeamten um 9 Uhr 620 m… Erfolgreiche Wiederbelebung bei versehentlicher Unterkühlung weiterlesen
Unterdrückung der Artefakte der Herz-Lungen-Wiederbelebung anhand der momentanen Herzdruckfrequenz
Die neuesten Richtlinien des European Resuscitation Council und der American Heart Association (AHA) betonen die Bedeutung einer frühen, ununterbrochenen Thoraxkompression in Kombination mit einer frühen Defibrillation für ein erfolgreiches Ergebnis nach einem Herzstillstand.1, 2 Die Richtlinien empfehlen, die Zeit vor und nach dem Schock zu minimieren -Schockpausen während der Herz-Lungen-Wiederbelebung (CPR) und der Fortsetzung der… Unterdrückung der Artefakte der Herz-Lungen-Wiederbelebung anhand der momentanen Herzdruckfrequenz weiterlesen